Naviguer dans l’industrie pharmaceutique peut être difficile et gourmand en ressources. La Nouvelle Demande de Médicament 505(b)(2) (NDA) offre une voie rationalisée dans le processus d’approbation des médicaments, permettant aux entreprises de commercialiser des produits innovants plus efficacement. Cet article examine en profondeur la voie 505(b)(2), ses avantages et son rôle crucial dans le développement de médicaments, fournissant aux entreprises pharmaceutiques les informations nécessaires pour optimiser leurs stratégies.
Qu’est-ce que le 505b2 ?
La nouvelle demande de médicament 505(b)(2) (NDA) est l’une des trois voies d’approbation des médicaments de l’Agence américaine des produits alimentaires et médicamenteux (FDA), représentant une stratégie réglementaire attrayante pour de nombreux clients. Établie par les amendements Hatch-Waxman de 1984, la voie 505(b)(2) fait référence à une section de la Loi fédérale sur les aliments, les médicaments et les cosmétiques. En Europe, ce type d’innovations a communément été appelé « Super génériques » ou « Génériques+, » mais récemment, le terme « Médicaments à Valeur Ajoutée » est devenu l’expression de référence.
Les dispositions du 505(b)(2) ont été créées pour éviter la duplication inutile d’études déjà réalisées sur un médicament précédemment approuvé, également connu sous le nom de médicament de référence ou répertorié. Cette voie permet à la FDA de s’appuyer sur des données non développées par le demandeur de la NDA. Un programme de développement complet est crucial pour maximiser la capacité de rationalisation de l’approche 505(b)(2) et accélérer le processus d’approbation réglementaire.
Une NDA 505(b)(2) contient des rapports complets sur la sécurité et l’efficacité, mais permet qu’au moins une partie des informations requises pour l’approbation de la NDA, telles que les informations sur la sécurité et l’efficacité du principe actif, provienne d’études non menées par ou pour le demandeur. Cela peut se traduire par une voie beaucoup moins coûteuse et beaucoup plus rapide vers l’approbation par rapport à un parcours de développement traditionnel, tel que le 505(b)(1), tout en créant de nouveaux produits différenciés avec une valeur commerciale considérable.
Les trois voies réglementaires pour l’approbation des médicaments
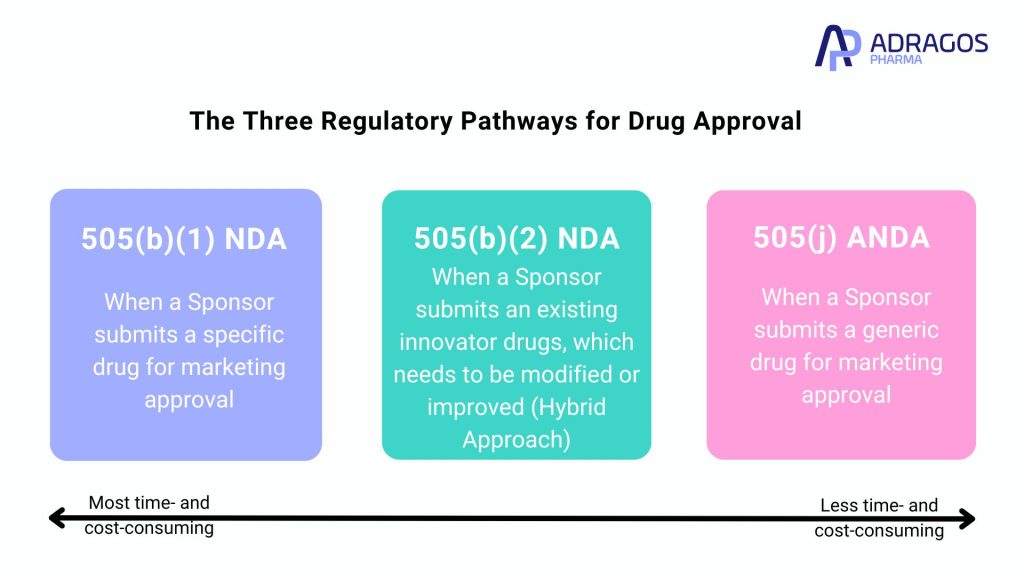
1. NDA 505(b)(1)
La NDA 505(b)(1) est une demande complète qui s’appuie entièrement sur des données originales. Chaque étude menée dans le cadre de cette voie est spécifiquement adaptée au médicament par le promoteur et sert de données fondamentales pour l’approbation de la FDA. Cette voie est la plus gourmande en ressources et la plus longue des trois.
2. ANDA 505(j)
Cette voie est conçue pour l’approbation des médicaments génériques. L’ANDA 505(j) devient pertinente lorsqu’un médicament innovant breveté approche de son expiration. Le critère central pour l’approbation par cette voie est la démonstration de la bioéquivalence avec le produit innovant. Pour les formes posologiques orales, une étude de l’effet des aliments est généralement requise pour garantir des profils d’efficacité et de sécurité similaires.
3. NDA 505(b)(2)
Une demande hybride, la NDA 505(b)(2) combine des aspects de la NDA complète et de l’ANDA. Cette voie est idéale pour les versions modifiées ou améliorées de médicaments innovants existants, conduisant à la création d’un produit médicamenteux distinct avec ses propres droits d’exclusivité. Le processus incorpore des données préexistantes et de nouvelles découvertes pour faciliter un processus d’approbation plus efficace. La préparation de matériaux d’essais cliniques qui reflètent le processus de fabrication commercial pour les études de phase 1 est cruciale, impliquant un travail CMC important avant le début de l’étude, y compris la préparation de lots de stabilité pour la détermination de la durée de conservation. En Europe, un processus similaire est connu sous le nom de demande hybride, reflétant sa nature combinée.
Candidats médicamenteux avec un potentiel 505b2
Nouvelles formes posologiques
Une entreprise peut souhaiter créer une nouvelle forme posologique qui agit plus rapidement, combine deux ingrédients actifs de manière novatrice, ou fournit une voie d’administration ou un mécanisme de délivrance du médicament que les patients ou les médecins préfèrent aux versions précédentes.
Nouvelles indications
Les entreprises peuvent chercher à obtenir l’approbation pour une nouvelle indication d’un médicament déjà approuvé ou effectuer un passage de Rx à OTC. Ces nouveaux produits contiennent souvent des ingrédients actifs bien compris présents dans des produits médicamenteux existants et approuvés.
Avantages de la voie 505b2
Risque et coût réduits
La voie 505(b)(2) est particulièrement précieuse pour les entreprises pharmaceutiques et de génériques cherchant à atténuer les forces concurrentielles dans leurs environnements tout en bénéficiant d’un processus de développement qui élimine la plupart des études non cliniques et des tests approfondis de sécurité et d’efficacité. La voie offre un risque relativement plus faible en raison de l’approbation préalable du médicament, et le processus de développement est généralement plus rapide et moins coûteux.
Exclusivité de marché et exclusivité des médicaments orphelins
La voie 505(b)(2) présente également une opportunité d’exclusivité de marché allant de 3 à 7 ans, offrant un avantage commercial significatif et permettant aux entreprises de récupérer leur investissement avant de faire face à la concurrence des génériques. De plus, les produits approuvés dans le cadre de cette voie peuvent bénéficier de divers types d’exclusivité de marché, y compris l’exclusivité des médicaments orphelins pendant sept ans.
Viabilité commerciale
Assurer la viabilité commerciale implique une évaluation rigoureuse des candidats et une planification stratégique. Les développeurs doivent évaluer la demande du marché, la concurrence potentielle et positionner stratégiquement leurs produits pour un impact maximal.
Naviguer dans le processus de soumission 505b2
Identification des candidats
La sélection de produits médicamenteux appropriés pour la voie 505(b)(2) est cruciale. Cette étape implique quelques études non cliniques pour s’assurer que le profil pharmacocinétique (PK) du nouveau produit est aussi favorable que celui du produit innovant.
Évaluation des candidats
Une évaluation rigoureuse de la viabilité scientifique, médicale, réglementaire et commerciale du candidat est essentielle. Ce processus aide à valider le concept du produit et à minimiser les erreurs coûteuses.
Planification du produit
L’incorporation stratégique de données existantes lors de la planification du produit est vitale. Les développeurs doivent évaluer les opportunités potentielles d’exclusivité de marché et planifier leurs programmes de développement en conséquence.
Réunion pré-IND
La réunion pré-IND avec la FDA est une étape cruciale dans la voie 505(b)(2). Cette réunion vise à obtenir l’avis de la FDA sur les études et stratégies prévues, rationalisant le processus d’approbation et réduisant les coûts.
Étapes détaillées du processus d’approbation 505b2
Conduite d’études de transition
Certaines différences dans la formulation ou l’administration peuvent nécessiter des études cliniques supplémentaires, mais celles-ci sont généralement moins étendues que celles requises pour les médicaments innovants originaux. Souvent, une étude de bioéquivalence suffit pour démontrer la similarité.
Incorporation de données préexistantes
La capacité d’utiliser des données préexistantes accélère considérablement le processus d’approbation. En faisant référence aux données de sécurité et d’efficacité du médicament original, les demandeurs peuvent éviter la nécessité d’études nouvelles étendues.
Utilisation stratégique des données existantes
L’incorporation de données existantes dans la stratégie de développement est essentielle pour optimiser le processus d’approbation. L’évaluation de l’exclusivité potentielle du marché et la planification des programmes de développement en conséquence peuvent améliorer la proposition de valeur du produit.
Surmonter les défis
Défis réglementaires
Naviguer dans la voie 505(b)(2) nécessite une compréhension approfondie des exigences réglementaires. Les entreprises doivent assurer la conformité aux directives de la FDA et gérer efficacement le processus d’approbation.
Considérations de marché
Les considérations de marché comprennent l’évaluation de la concurrence, l’évaluation de la demande du marché et l’assurance de la viabilité commerciale du produit. Un positionnement stratégique est crucial pour maximiser l’impact sur le marché et la rentabilité.
La voie 505(b)(2) offre aux entreprises pharmaceutiques une opportunité précieuse de commercialiser des produits innovants de manière plus efficace et rentable. En exploitant les données préexistantes et en minimisant les études redondantes, cette voie facilite un processus d’approbation rationalisé, réduisant le temps et l’investissement financier.
FAQ sur le 505b2
Quelle est la différence entre NDA et 505(b)(2) ?
Une NDA (Nouvelle Demande de Médicament) s’appuie entièrement sur des données originales, tandis qu’une demande 505(b)(2) permet l’utilisation de données préexistantes pour rationaliser le processus d’approbation.
Quelle est la différence entre ANDA et 505(b)(2) ?
L’ANDA (Demande Abrégée de Nouveau Médicament) est utilisée pour les médicaments génériques et nécessite de démontrer la bioéquivalence avec le produit innovant. En revanche, une demande 505(b)(2) est utilisée pour des versions modifiées ou améliorées de médicaments existants et permet l’utilisation de données préexistantes.
Qu’est-ce qu’une nouvelle entité moléculaire 505(b)(2) ?
Une nouvelle entité moléculaire 505(b)(2) fait référence à une nouvelle entité chimique développée par la voie 505(b)(2), exploitant des données préexistantes pour rationaliser le processus d’approbation.
Quel est l’équivalent européen du 505(b)(2) ?
L’équivalent européen de la voie 505(b)(2) est connu sous le nom de demande hybride, basée sur l’article 10 de la directive 2001/83/CE. Cette voie, similaire au 505(b)(2), permet l’utilisation de données existantes d’un médicament de référence, complétées par de nouvelles données cliniques ou précliniques pour soutenir des changements de formulation, de forme posologique, de dosage ou d’indication.
Quelle est la probabilité de réussite d’un 505(b)(2) ?
La probabilité de succès d’une demande 505(b)(2) est généralement plus élevée que celle d’une NDA traditionnelle 505(b)(1) en raison de l’utilisation de données existantes, ce qui réduit le risque et l’incertitude associés au développement de médicaments. Bien que les taux de réussite exacts puissent varier en fonction du médicament spécifique et des modifications proposées, les analyses de l’industrie suggèrent que les demandes 505(b)(2) ont une probabilité d’approbation plus élevée, souvent citée autour de 70-75%, comparée aux taux de réussite significativement plus bas généralement associés aux approbations de nouvelles entités moléculaires (NME).
