La découverte et le développement de médicaments constituent la pierre angulaire des avancées pharmaceutiques, englobant la transformation de concepts scientifiques prometteurs en médicaments approuvés et efficaces. Ce parcours complexe implique de multiples étapes, chacune essentielle pour garantir que les nouveaux médicaments sont sûrs, efficaces et prêts pour le marché.
Avec l’avancement de l’intelligence artificielle (IA) et de l’apprentissage automatique (AA), le développement de médicaments devient plus rapide et plus précis, révolutionnant l’identification des cibles, l’optimisation des têtes de série et le criblage à haut débit. Dans cet article, nous explorerons en détail le processus de développement de médicaments, offrant des aperçus de chaque phase tout en soulignant l’importance de la recherche scientifique, de la conformité réglementaire et des technologies émergentes.
Qu’est-ce que le processus de développement de médicaments ?
Le processus de développement de médicaments est une série d’étapes structurées conçues pour transformer de nouvelles idées de médicaments en agents thérapeutiques commercialisables. Les sociétés pharmaceutiques jouent un rôle crucial dans ce processus, surveillant la sécurité de leurs médicaments à l’aide du système de notification des événements indésirables de la FDA (FAERS) et d’études de surveillance post-commercialisation.
Les technologies émergentes telles que la découverte de médicaments assistée par l’IA, la conception de médicaments assistée par ordinateur (CADD) et les innovations en matière d’administration de médicaments contribuent à accélérer le développement de petites molécules et de produits biologiques pour diverses maladies, y compris le cancer, les troubles neurologiques et les maladies rares.
Phases du processus de développement de médicaments
Le processus de développement de médicaments implique plusieurs étapes, notamment la découverte de médicaments, les tests précliniques et cliniques, l’approbation réglementaire et la surveillance post-commercialisation. Chaque phase est méticuleusement planifiée pour garantir que seuls des médicaments sûrs et efficaces parviennent aux patients.
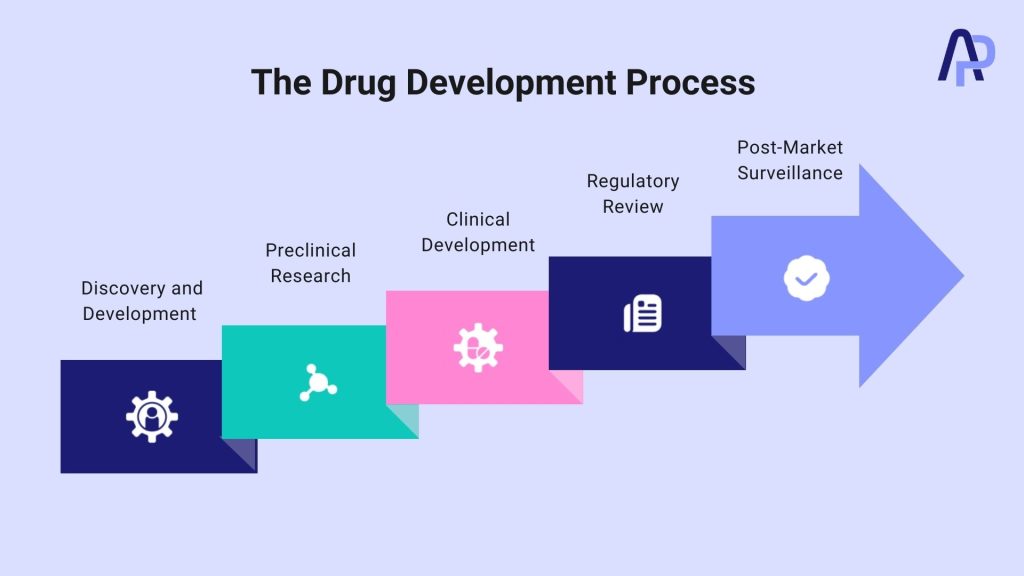
Étape 1 : découverte et développement
Le parcours commence par l’identification des cibles médicamenteuses potentielles. Les chercheurs utilisent :
- L’intelligence artificielle (IA) et l’apprentissage automatique (AA) pour analyser de vastes ensembles de données à la recherche de nouveaux candidats médicaments.
- Le criblage à haut débit (HTS) pour tester rapidement des milliers de composés chimiques pour leur potentiel thérapeutique.
- L’identification de cibles et l’optimisation des têtes de série pour affiner les meilleurs composés pour le développement de médicaments.
💡 La découverte de médicaments assistée par l’IA a considérablement raccourci les délais en prédisant les interactions moléculaires et en optimisant les composés principaux avant de passer aux tests précliniques.
Étape 2 : recherche préclinique
Avant qu’un médicament n’entre dans les essais humains, il subit des études précliniques rigoureuses pour garantir sa sécurité, sa toxicité et sa pharmacocinétique.
Aspects clés du développement préclinique de médicaments :
- Modèles animaux et tests in vitro : Évaluation de la toxicité et des effets thérapeutiques dans des cultures cellulaires et des modèles animaux (par exemple, rongeurs, primates).
- Pharmacocinétique et pharmacodynamique (PK/PD) : Compréhension de la façon dont le médicament est absorbé, distribué, métabolisé et excrété (ADME).
- Études toxicologiques : Évaluation des effets secondaires potentiels et de la dose maximale tolérée (DMT).
Une fois que le médicament démontre sa sécurité, les chercheurs déposent une demande de nouveau médicament de recherche (IND) auprès de la FDA pour obtenir l’approbation des essais sur l’homme.
Étape 3 : développement clinique
Les essais cliniques sont divisés en plusieurs phases (I-IV), chacune conçue pour évaluer systématiquement la sécurité, l’efficacité et le dosage optimal d’un nouveau médicament.
Phase I : sécurité et dosage chez les volontaires sains
- Menée sur un petit groupe de participants sains.
- Détermine le métabolisme du médicament, sa biodisponibilité et ses effets secondaires potentiels.
Phase II : efficacité et sécurité chez les patients
- Implique un groupe plus important de patients atteints de la maladie cible.
- Évalue l’efficacité thérapeutique et les effets secondaires à court terme.
Phase III : essais à grande échelle pour l’approbation réglementaire
- Inclut des milliers de patients dans plusieurs sites.
- Génère des données complètes pour l’examen réglementaire (FDA, EMA, etc.).
💡 L’IA dans les essais cliniques aide à optimiser la sélection des patients et à prédire les résultats des essais, réduisant ainsi les taux d’échec.
Étape 4 : examen réglementaire
Après des essais de Phase III réussis, une demande de nouveau médicament (NDA) ou une demande de licence de produit biologique (BLA) est soumise aux agences réglementaires telles que :
- L’Administration américaine des aliments et des médicaments (FDA)
- L’Agence européenne des médicaments (EMA)
- D’autres organismes de réglementation dans le monde
Les agences réglementaires évaluent :
✔ Les données d’efficacité et de sécurité
✔ L’analyse risques-bénéfices
✔ Les normes de fabrication et de contrôle qualité
💡 Les voies d’approbation de la FDA (par exemple, Fast Track, Breakthrough Therapy, Priority Review) aident à accélérer le développement de médicaments pour les maladies critiques comme le cancer et les troubles génétiques rares.
Étape 5 : surveillance post-commercialisation
Études de phase IV
Une fois qu’un médicament est approuvé, les essais de Phase IV (post-commercialisation) continuent de surveiller :
- La sécurité à long terme et l’efficacité en conditions réelles
- Les interactions médicamenteuses et les événements indésirables rares
- Études de pharmacovigilance
La FDA, l’EMA et les sociétés pharmaceutiques utilisent des données du monde réel (RWD) et l’intelligence artificielle pour détecter les effets secondaires rares.
💡 La surveillance post-commercialisation est essentielle pour garantir la sécurité des patients, car certains effets secondaires n’apparaissent qu’après des années d’utilisation généralisée.
Tendances émergentes dans le développement de médicaments
L’industrie pharmaceutique évolue rapidement avec des innovations de pointe telles que :
✅ L’IA et l’apprentissage automatique dans la découverte de médicaments – Identification plus rapide de nouveaux candidats médicaments.
✅ La thérapie par cellules CAR-T – Traitements personnalisés contre le cancer.
✅ Les technologies avancées d’administration de médicaments – Amélioration de la biodisponibilité et de l’administration ciblée de médicaments.
✅ La conception de médicaments assistée par ordinateur (CADD) – Amélioration de la découverte de petites molécules.
Des organisations comme le Cancer Drugs Fund (Royaume-Uni) et la Fondation Oak financent des recherches à fort impact sur le développement de médicaments.
Le processus de développement de médicaments est un parcours complexe mais gratifiant qui transforme les découvertes scientifiques en médicaments qui sauvent des vies. De l’identification des cibles et la découverte de médicaments assistée par l’IA aux essais cliniques et à la surveillance post-commercialisation, chaque étape garantit la sécurité, l’efficacité et la conformité réglementaire des médicaments.
💡 Avec l’IA, l’apprentissage automatique et la collecte de preuves du monde réel, l’avenir du développement pharmaceutique est appelé à devenir plus efficace, rentable et centré sur le patient.
🚀 Alors que des innovations comme la découverte de médicaments assistée par l’IA et la médecine de précision progressent, nous pouvons nous attendre à des avancées plus rapides dans le traitement des maladies dans le monde entier.
Points clés à retenir
✅ L’IA et l’apprentissage automatique transforment la découverte de médicaments.
✅ Les agences réglementaires (FDA, EMA) jouent un rôle crucial dans l’approbation des médicaments.
✅ Les essais cliniques (Phases I-IV) sont essentiels pour la sécurité et l’efficacité.
✅ La surveillance post-commercialisation assure la sécurité à long terme des médicaments.
✅ Les innovations en matière d’administration de médicaments améliorent les résultats thérapeutiques.
FAQ sur le processus de développement de médicaments
Quelle est la voie de développement de nouveaux médicaments ?
La voie comprend la découverte de médicaments, les tests précliniques, les essais cliniques, l’examen réglementaire et la surveillance post-commercialisation pour garantir la sécurité et l’efficacité du médicament.
Quelle est la différence entre les essais cliniques de phase I, phase II et phase III ?
Les essais de phase I se concentrent sur la sécurité et le dosage avec un petit groupe de volontaires sains ou de patients. Les essais de phase II élargissent l’objectif pour inclure l’efficacité et des tests de sécurité supplémentaires sur un groupe plus important de patients. Les essais de phase III impliquent des tests à grande échelle pour confirmer l’efficacité, surveiller les effets secondaires et comparer le médicament aux traitements couramment utilisés.
Quelle est généralement la durée du processus de développement d’un médicament ?
Le processus de développement d’un médicament peut prendre de 10 à 15 ans, en fonction de la complexité du médicament et de l’exhaustivité des tests requis.
Quels facteurs peuvent conduire à l’échec d’un médicament durant son développement ?
L’échec d’un médicament peut survenir en raison d’un manque d’efficacité, de problèmes de sécurité découverts lors des essais cliniques, ou de défis dans le processus de formulation et de fabrication. Les contraintes financières et les obstacles réglementaires peuvent également contribuer aux échecs du développement de médicaments.
Quelle est l’importance des études précliniques ?
Les études précliniques sont cruciales pour évaluer la sécurité et l’activité biologique d’un médicament en laboratoire et sur des modèles animaux avant de passer aux essais sur l’homme. Ces études fournissent une base pour comprendre le fonctionnement du médicament et ses risques potentiels.
